Kim loại và hợp kim - Phần 2
IV- Tính chất hóa học của kim loại
Tính chất hóa học đặc trưng của kim loại là tính khử
M → Mn+ + ne
Nguyên tử kim loại dễ bị oxi hóa thành ion dương
1. Tác dụng của kim loại với phi kim
| Oxi | Clo | Lưu huỳnh | |
| Tác dụng của kim loại với |
- Các kim loại (trừ Ag, Au, Pt) đều tác dụng với oxi cho oxit tương ứng. Ví dụ: 2Cu + O2  2CuO 2CuO- Lưu ý: Dựa vào phản ứng này người ta dùng để tách riêng rẽ Ag và Cu ra khỏi hỗn hợp có Ag, Cu. |
- Tất cả các kim loại đều |
Kim loại đun nóng với lưu huỳnh tạo thành sunfua kim loại. Vi dụ: Fe + S  FeS FeS |
2. Tác dụng của kim loại với các hợp chất
a. Tác dụng với nước
- Các kim loại K, Na, Ba, Ca tác dụng với nước giải phóng hiđro
M + nHOH → M(OH)n + n/2 H2
- Các kim loại Mg, Al lúc đầu tác dụng với nước (phản ứng xảy ra chậm) tạo ra Mg(OH)2, Al(OH)3 bám trên bề mặt Mg, Al tạo một lớp màng ngăn không cho hai kim loại tiếp tục tác dụng với nước.
- Các kim loại Fe, Mn, Cr,... (những kim loại đứng trước H trong dãy điện hóa của kim loại) tác dụng với nước ở nhiệt độ cao.
xM + yH2O  MxOy + yH2
MxOy + yH2
Ví dụ: 3Fe + 4H2O → Fe3O4 + 4H2 ↑
- Những kim loại có tính khử yếu như Pb, Cu, Ag, Hg,... không khử được nước ở nhiệt độ cao.
b. Tác dụng với dung dịch axit
- Với HCl và H2SO4 loãng
+ Chỉ có kim loại hoạt động (trước H) mới tác dụng với HCl, H2SO4 loãng cho muối clorua, muối sunfat (trong đó kim loại đa hoá trị chỉ đạt hoá trị thấp) và H2.
- Với H2SO4 đặc, HNO3 loãng, HNO3 đặc và đun nóng
Hầu hết các kim loại (trừ Au, Pt) khử được N+5 và S+6 trong các axit này xuống số oxi hoá thấp hơn.
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 ↑ + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2+ 2NO ↑ + 4H2O
2Fe + 6H2SO4 đặc  Fe2(SO4)3+ 3SO2 ↑ + 6H2O
Fe2(SO4)3+ 3SO2 ↑ + 6H2O
Fe + 6HNO3 đặc  Fe(NO3)3 + 3NO2 ↑ + 3H2O
Fe(NO3)3 + 3NO2 ↑ + 3H2O
+ Sản phẩm của phản ứng kim loại với axit có oxi còn tuỳ thuộc vào tính khử của kim loại, nồng độ của dung dịch axit, nhiệt độ tiến hành phản ứng.
Lưu ý một số trường hợp ngoại lệ:
- Một số kim loại (Al, Cr, Fe) không tác dụng với HNO3 đậm đặc hoặc H2SO4 đậm đặc ở nhiệt độ thường.
+ Đồng kim loại tan trong dung dịch HCl loãng hoặc H2SO4 loãng khi có oxi hoà tan
2Cu + O2  2CuO
2CuO
2CuO + 4HCl → 2CuCl2 + 2H2O
2Cu + O2 + 4HCl → 2CuCl2 + 2H2O
+ Khi cho kim loại tác dụng với dung dịch H2SO4 đặc, nóng khí thoát ra là khí SO2, vì H2S là chất khử, H2SO4 đặc là chất oxi hóa nên khí H2S không tồn tại.
2X + 2nH2SO4 → X2(SO4)n + nSO2 ↑ + 2nH2O
+ Vàng, bạch kim (Pt) tan trong nước cường thuỷ (nước cường thuỷ là hỗn hợp của 1 thể tích HNO3 đặc và 3 thể tích HCl đặc)

c. Tác dụng với kiềm
Các kim loại mà oxit và hidroxit của chúng lưỡng tính như Be, Zn, Cr, Al có thể tác dụng với kiềm.
- Với Be, Zn
Be + 2H2O → Be(OH)2 + H2 ↑
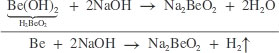
hoặc Be + 2NaOH + 2H2O → Na2Be(OH)4 + H2
- Với Al, Cr
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
hoặc Al + NaOH + H2O → NaAlO2 +  H2
H2
d. Tác dụng với dung dịch muối
- Trong dãy điện hóa, kim loại đứng trước (trừ Li, Na, K, Ca, Ba) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
- Kim loại hoạt động hóa học mạnh như Li, K, Ba, Ca, Na tác dụng với nước ở điều kiện thường, nên không đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối.
Ví dụ: Na + CuSO4
Na + H2O → NaOH + 1/2H2 ;
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
B- HỢP KIM
I- Định nghĩa
Hợp kim là vật liệu kim loại có chứa một hay nhiều nguyên tố. Nguyên tố trong hợp kim có thể là kim loại hoặc phi kim. Ví dụ: Thép là hợp kim sắt và cacbon, đuyra là hợp kim nhôm và đồng, mangan, magie.
II- Tính chất của hợp kim
Tính chất của hợp kim phụ thuộc vào thành phần các đơn chất tham gia hợp kim và cấu tạo mạng tinh thể của hợp kim.
Ví dụ:
Hợp kim không bị gỉ: Al - Mg, Cu - Zu, Fe - Mn - Cr.
Hợp kim siêu cứng: W - CO, CO - Cr, W - Fe.
Hợp kim có nhiệt độ nóng chảy thấp: Sn - Pb.
Hợp kim nhẹ, cứng và bền: Al - Si, Al - Cu - Mn - Mg.
III- Ứng dụng của hợp kim
Ngày nay con người chế tạo được nhiều loại hợp kim có những tính chất hoá học, vật lí và cơ học rất quý nên hợp kim được sử dụng rộng rãi trong các ngành kinh tế quốc dân.
- Hợp kim nhẹ, bền, chịu dược nhiệt độ cao, áp suất lớn dùng trong ngành công nghiệp máy bay, ôtô, tên lửa, tàu vũ trụ.
- Hợp kim có tính bền hóa học và cơ học cao dùng trong ngành công nghiệp dầu mỏ, công nghiệp hóa chất.
- Hợp kim cứng và bền dùng trong ngành xây dựng cầu cống, nhà cửa.
- Hợp kim không gỉ, vẻ sáng đẹp không độc hại để chế tạo các đồ dùng trong gia đình, dụng cụ nhà bếp.










