Nhôm
1. Cấu tạo

Hình: Nhôm
Cấu hình etectron của Al: 1s22s22p63s23p1. Al là nguyên tố p
Al → Al3+ + 3e
Mạng tinh thể: Nhôm có cấu tạo kiểu mạng lập phương tâm diện.
2. Tính chất hóa học
2.1. Tác dụng với phi kim
a. Tác dụng với oxi
Khi đốt nóng, bột nhôm cháy trong không khí
4Al + 3O2  2 Al2O3
2 Al2O3
b. Tác dụng với clo
Bột nhôm tự bốc cháy khi tiếp xúc với khí clo
2Al + 3Cl2 → 2AlCl3
c. Tác dụng với C, S, N,...
2Al + N2  2AlN
2AlN
2Al + 3S  Al2S3.
Al2S3.
2.2. Tác dụng với axit
a. Với HCl loãng cũng như đặc, H2SO4 loãng cho H2 bay ra.
b. Với H2SO4 đặc, nóng tuỳ theo nồng độ tính khử của kim loại, điều kiện phản ứng mà tạo ra sản phẩm khử khác nhau: SO2, S, H2S .
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 ↑ + 6H2O
2Al + 4H2SO4 → Al2 (SO4)3 + S ↓ + 4H2O
8Al + 15H2SO4 → 4Al2(SO4)3 + 3H2S + 12H2O
c. Với HNO3
- Al phản ứng với HNO3 đặc, nóng cho khí NO2.
- Al phản ứng với HNO3 loãng cho NO, N2O, N2, NH4NO3 và muối nitrat.
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
- Al không tác dụng với HNO3 rất loãng.
- Với HNO3 đặc, nguội và H2SO4 đặc, nguội: Al, Fe bị thụ động không có phản ứng, do chúng bị oxi hóa tạo các lớp oxit bền vững.
2.3. Tác dụng với nước
2Al + 6H2O → 2Al(OH)3 ↓ + 3H2 ↑
Phản ứng nhanh chóng dừng lại vì Al(OH)3, không tan trong nước đã ngăn cản không cho nhôm tiếp xúc với nước.
2.4. Tác dụng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều oxit kim loại yếu hơn như CuO, Fe2O3, Cr2O3,... thành kim loại gọi là phản ứng nhiệt nhôm.
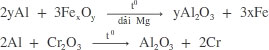
2.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 6H2O → 2Na [Al(OH)4 ] + 3H2 ↑
2.6. Tác dụng với dung dịch muối
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
3. Điều chế
Al2O3  2Al + 3/2O2
2Al + 3/2O2
- Ở cực âm xảy ra sự khử ion Al3+ : Al3+ + 3e → Al
- Ở cực dương xảy ra sự ion hoá các ion O2- : 2O2- → O2 + 4e
- Không thể điều chế Al bằng cách dùng H2, CO, C đế khử Al2O3 ở bất kì nhiệt độ nào.










