Hướng dẫn bài tập kim loại kiềm, kiềm thổ và nhôm
BÀI TẬP VỀ KIM LOẠI KIỀM, KIỀM THỔ VÀ NHÔM
1. Bài tập về kim loại kiềm và các hợp chất của kim loại kiềm
Dạng 1: Kim loại kiềm tác dụng với nước hoặc dung dịch axit
+ Kim loại kiềm tác dụng với nước hoặc với dung dịch axit là phản ứng oxi hóa - khử, trong đó kim lọi kiềm thể hiện tính khử mạnh:
M + 2H+ → M+ + H2↑
+ Khi kim loại kiềm tác dụng với dung dịch axit thì do tính oxi hóa của axit lớn hơn của nước nên khi cho kim loại kiềm dư (cho từng lượng nhỏ) vào dung dịch axit thì phản ứng xảy ra theo thứ tự ưu tiên:
2M + 2H+ → 2M+ + H2 (1)
2M + 2H2O → 2M+ + 2OH- + H2 (2)
+ Phương pháp giải bài tập dạng này chủ yếu là tính toán theo phương trình phản ứng. Đối với hỗn hợp các kim loại kiềm thì nên sử dụng phương pháp trung bình, phương pháp đường chéo. Khi gặp bài tập hỗn hợp kim loại kiềm phản ứng với các chất oxi hóa khác nhau thì nên sử dụng phương pháp bảo toàn electron, bảo toàn khối lượng.
Ví dụ 1:Cho 3,9 gam kali vào 101,8 gam nước thu được dung dịch KOH có nồng độ % là bao nhiêu ?
- 5,31%. B. 5,20%. C. 5,30%. D. 5,50%.
Hướng dẫn giải
Theo giả thiết ta có : số mol K = 0,1 mol
Phương trình phản ứng :
2K + 2H2O → 2KOH + H2 (1)
mol: 0,1 0,05
Theo (1) và áp dụng định luật bảo toàn khối lượng ta có :
mdd sau pư = khối lượng K + khối lượng H2O – khối lượng H2 = 105,6 gam
Nồng độ phần trăm của dung dịch KOH là : (0,1.56)/105,6 = 5,3%
=> Đáp án C.
Dạng 2: Pha chế dung dịch kiềm
Đối với dạng bài tập này ta thường sử dụng phương pháp đường chéo hoặc tính toán đại số thông thường.
Ví dụ 2: Từ 20 gam dung dịch NaOH 40% và nước cất pha chế dung dịch NaOH 16%. Khối lượng nước (gam) cần dùng là :
A.27. B. 25,5. C. 54. D. 30.
Hướng dẫn giải
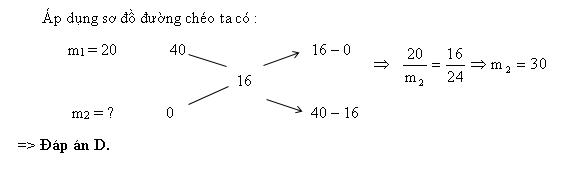
Dạng 3: Dung dịch kiềm phản ứng với oxit axit
- Khi cho CO2 hoặc SO2 vào kiềm
Thứ tự phản ứng xảy ra như sau: CO2 + OH- → HCO3- (1)
Nếu vẫn còn OH- dư thì xảy ra phản ứng: HCO3- + OH- → CO32- + H2O (2)
Đặt k= số mol OH-/ số mol CO2 (hoặc k= số mol OH-/ số mol SO2)
o k ≥ 2 : chỉ tạo muối CO32-
o k ≤ 1 : chỉ tạo muối HCO3-
o 1 < k < 2 : tạo cả muối HCO3- và CO32-
Có những bài toán không thể tính k. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
VD: Hấp thụ CO2 vào NaOH dư => chỉ tạo muối Na2CO3. Hấp thụ CO2 vào NaOH.Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa
=> Tạo cả 2 muối Na2CO3 và NaHCO3
=> Trong trường hợp không có các dữ kiện trên thì chia trường hợp để giải.
- Biết lượng kết tủa CaCO3, lượng Ca2+ tính thể tích CO2
+ Nếu cho CO2 phản ứng với lượng Ca(OH)2 dư thì chỉ tạo muối CO32- khi đó số mol CO2 = số mol CaCO3.
+ Nếu số mol CaCO3 < số mol Ca(OH)2 thì có 2 trường hợp
(1) Ca(OH)2 dư nên số mol CO2 = số mol CaCO3 và khi đó tính được V khí nhỏ nhất
(2) Ca(OH)2 tạo hết kết tủa sau đó kết tủa tan một phần:
Thứ tự phản ứng: CO2 + OH- → HCO3- (1)
HCO3- + OH- → CO32- + H2O (2)
CO32- + CO2 + H2O → 2HCO3- + H2O (3)
thì số mol CO2 = 2.sô mol OH- - số mol CaCO3và khi đó tính được V khí lớn nhất.
- Biết lượng CO2, lượng hỗn hợp NaOH và Ca (OH)2 tính lượng kết tủa.
Cần xác định được số mol Ca2+, số mol CO32-
+ Nếu số mol Ca2+ < số mol CO32- thì số mol kết tủa = số mol Ca(OH)2
+ Nếu số mol Ca2+ > số mol CO32- thì số mol kết tủa = số mol CO32-
- Cần chú ý các thuật ngữ: Phản ứng hoàn toàn, lượng kiềm dư, thể tích CO2 lớn nhất, lượng CO2 nhỏ nhất, đun kĩ dung dịch thu thêm một lượng kết tủa nữa để xác định đúng trường hợp phản ứng
- Đối với dạng bài tập này ta thường sử dụng phương pháp đường chéo hoặc tính toán theo phương trình ion rút gọn và phương pháp nguyên tử khối trung bình.
Ví dụ 3:Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II, sau khi phản ứng xảy ra hoàn toàn thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là
A. 4,2 gam. B. 6,5 gam. C. 6,3 gam. D. 5,8 gam.
Hướng dẫn giải
Nung muối cacbonat thu được khí X là CO2.
CO3 O + CO2 (1)
Áp dụng định luật bảo toàn khối lượng ta có : khối lượng muối X = khối lượng chất rắn + khối lượng CO2
=> khối lượng CO2 = 13,4 – 6,8 = 6,6 gam => số mol CO2 = 0,15 mol
Số mol NaOH = 0,075.1 = 0,075 mol
Ta có số mol CO2 : số mol NaOH < 1 => muối tạo ra là NaHCO3
CO2 + NaOH → NaHCO3 (2)
mol: 0,075 → 0,075 → 0,075
Theo (2) ta thấy số mol của NaHCO3 là 0,075 mol nên suy ra khối lượng của NaHCO3 = 0,075.84 = 6,3 gam.
=> Đáp án C.
Dạng 4: Dung dịch NaOH, KOH phản ứng với dung dịch H3PO4 hoặc P2O5
- Tính tỉ lệ số mol OH- / số mol axit để từ đó xác định sản phẩm sinh ra trong phản ứng.
Phương trình phản ứng là một trong các trường hợp sau:
+ Nếu số mol NaOH- ≤ số mol H3PO4 thì xảy ra
NaOH + H3PO4 → NaH2PO4 + 2H2O (1)
+ Nếu số mol NaOH- = 1/2 số mol H3PO4 thì xảy ra
2NaOH + H3PO4 → Na2HPO4 + 2H2O (2)
+ Nếu số mol NaOH- ≥ 1/3 số mol H3PO4 thì xảy ra
3NaOH + H3PO4 → Na3PO4 + 3H2O (3)
- Nêú cho từ từ dung dịch OH- vào H3PO4 thì thứ tự phản ứng xảy ra:
NaOH + H3PO4 → NaH2PO4 + H2O (1)
Ta xét tương quan số mol NaOH với H3PO4 , nếu NaOH còn dư thì xảy ra phản ứng 2:
NaOH + NaH2PO4 → Na2HPO4 + H2O (2)
Ta xét tương quan số mol NaOH với NaH2PO4 , nếu NaOH còn dư thì xảy ra phản ứng 3:
NaOH + Na2HPO4 → Na3PO4 + H2O (3)
- Đối với P2O5 thì P2O5 + 3H2O → 2H3PO4 sau đó làm như hướng dẫn trên.
Trên đây chỉ là các bước cơ bản để giải bài tập dạng này, ngoài ra để tính toán nhanh ta cần áp dụng linh hoạt định luật bảo toàn khối lượng, bảo toàn nguyên tố, phương pháp đường chéo, phương pháp sử dụng phương trình ion rút gọn…
Ví dụ 4:Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là :
A. 14,2 gam. B. 15,8 gam. C.16,4 gam. D.11,9 gam.
Hướng dẫn giải
Ta có : số mol NaOH = 0,2.1 = 0,2 mol
số mol H3PO4 = 0,2.05 = 0,1 mol
Vì số mol số mol NaOH : số mol H3PO4 = 2:1 nên sản phẩm là Na2HPO4.
Phương trình phản ứng :
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
mol: 0,2 → 0,1 → 0,1
Khối lượng muối thu được = 142.0,1 = 14,2 gam
=> Đáp án A.
Dạng 6: Dung dịch muối CO32- và HCO3- phản ứng từ từ với dung dịch axit hoặc ngược lại
- Cho từ từ dung dịch chứa ion H+ (HCl, H2SO4, HNO3) vào dung dịch chứa các ion CO32- và HCO3- thì phản ứng xảy ra theo thứ tự ưu tiên :
HCO3- + H+ → CO2 + H2O (2)
Hiện tượng phản ứng: lúc đầu không có khí, sau đó có khí không màu thoát ra.
Bài toán thuộc dạng lượng dư - lượng hết. => Phương pháp giải : Viết phương trình dạng ion rút gọn, xác định chính xác chất phản ứng hết , chất còn dư, tính theo lượng chất phản ứng hết.
- Cho từ từ dung dịch chứa các ion CO32- và HCO3- vào dung dịch chứa ion H+ (HCl, H2SO4, HNO3) thì phản ứng xảy ra đồng thời theo đúng tỉ lệ mol của các ion CO32- và HCO3- có trong dung dịch.
Phản ứng (1) và (2) xảy ra đồng thời.
● Lưu ý : Trong dạng bài tập này thì lượng H+ mà đề bài cho thường không đủ để chuyển hết các ion CO32- và HCO3- thành CO2 nên cho từ từ dung dịch chứa ion H+ (HCl, H2SO4, HNO3)vào dung dịch chứa các ion CO32- và HCO3- và làm ngược lại thì sẽ thu được lượng CO2 khác nhau.
3. Khi đổ nhanh dung dịch chứa ion H+ vào dung dịch chứa các ion CO32- và HCO3- hoặc làm ngược lạimà H+ bị thiếu thì ta chỉ tìm được khoảng thể tích khí CO2 giải phóng chứ không tính được chính xác thể tích CO2.
- Tìm khoảng thể tích CO2 bằng cách xét 2 trường hợp :
+ Trường hợp 1: H+ phản ứng với CO32- trước, với HCO3- sau, suy ra VCO2 = V1
+ Trường hợp 2: H+ phản ứng với HCO3- trước, với CO32- sau, suy ra VCO2 = V2
Từ hai trường hợp trên ta suy ra : V1 ≤ VCO2 ≤ V2 .
- Trong trường hợp axit dư thì: CO32- + 2H+ → CO2 + H2O (1)
HCO3- + H+ → CO2 + H2O (2)
Ví dụ 5Thêm từ từ đến hết dung dịch chứa 0,2 mol KHCO3 và 0,1 mol K2CO3 vào dung dịch chứa 0,3 mol HCl. Thể tích khí CO2 (đktc) thu được là :
- 4,48 lít. B. 5,04 lít. C. 3,36 lít. D. 6,72 lít.
Hướng dẫn giải
Để phản ứng hết với các muối KHCO3 và K2CO3 thì lượng HCl cần dùng là :
0,02 + 0,1.2= 0,4 mol > 0,3 mol => HCl thiếu, lượng CO2 tính theo HCl.
Theo giả thiết ta cósố mol HCO3- : số mol CO32- = 2 :1
Do đó ta gọi số mol củacác ion HCO3- và CO32-tham gia phản ứng là 2x và x.
Khi cho từ từ dung dịch chứa các ion CO32- và HCO3- vào dung dịch chứa ion H+ thì phản ứng xảy ra đồng thời (1) và (2):
CO32- + 2H+ → CO2 + H2O (1)
mol: x 2x x
HCO3- + H+ → CO2 + H2O (2)
mol 2x 2x 2x
=> số mol H+ = 4x = 0,3 => x 0,075 => VCO2 = 3x.22,4 = 5,04 lit
=> Đáp án B.
2. Bài tập về kim loại kiềm thổ và các hợp chất của kim loại kiềm thổ
- Bản chất phản ứng của kim loại kiềm thổ với các chất (nước, axit, muối, phi kim...) là phản ứng oxi hóa - khử.
● Phương pháp giải các bài tập dạng này chủ yếu là sử dụng định luật bảo toàn electron và phương trình ion rút gọn. Ngoài ra có thể sử dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố và tính toán theo phương trình phản ứng. Đối với bài tập liên quan đến hỗn hợp các kim loại kiềm thổ thì nên sử dụng phương pháp trung bình.
Dạng 1: Kim loại kiềm thổ phản ứng với phi kim
* Trong phản ứng với phi kim, kim loại kiềm thổ thể hiện tính khử mạnh:
M → M2+ + 2e
* Phi kim phản ứng thể hiện tính oxi hóa:
X + ne → Xn-
Ví dụ 6:Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Kim loại M là
A. Mg. B. Ca. C. Be. D. Cu.
Hướng dẫn giải
Theo giả thiết ta có : số mol khí = 5,6/22,4 = 0,25 mol
Sơ đồ phản ứng: 7,2 gam kim loại M + 5,6 lít ↑hỗn hợp Cl2 và O2 → 23,0 gam chất rắn
Áp dụng bảo toàn khối lượng => khối lượng hỗn hợp Cl2 và O2 = 23 – 7,2 = 15,8 gam
Gọi x và y lần lượt là số mol của Cl2 và O2 ta có :x + y = 0,25 và 71x + 32y = 15,8 => x = 0,2; y = 0,05
M → Mn+ + ne
Cl2 → 2Cl-
O2 → 2O2-
Áp dụng định luật bảo toàn electron ta có : n. nM = 2.nClo + 4.noxi => (7,2/M).n = 0,2.2 + 0,05.4=> n = 2; M = 24 (Mg)
=> Đáp án A.
Dạng 2: Kim loại kiềm thổ phản ứng với nước
* Trong phản ứng với nước, kim loại kiềm thổ thể hiện tính khử mạnh:
M → M2+ + 2e
* Nước phản ứng thể hiện tính oxi hóa:
H2O + 2e → 2OH- + H2↑
Ví dụ 7:Cho a gam kim loại M tan hết vào H2O thu được dung dịch có khối lượng lớn hơn khối lượng H2O ban đầu là 0,95a gam. M là
A. Na. B. Ba. C. Ca. D. Li.
Hướng dẫn giải
Gọi số mol M là x, khi đó x = a/M
Phương trình phản ứng :
2M + 2nH2O 2M(OH)n + nH2 (1)
=> số mol H2 = (n/2)(a/M) = an/2M
Khối lượng dung dịch tăng = mM – mH2 = 0,95a
=> mH2 = 0,05a => số mol H2 = (n/2)x = 0,025a (mol)
=> x = a/M = 0,025a / (n/2) => M = 20n (với n =1,2,3 thì nghiệm hợp lí là n = 2, M =40)
=> M là Ca.
=> Đáp án C.
Dạng 3: Kim loại kiềm thổ phản ứng với axit
* Trong phản ứng với axit, kim loại kiềm thổ thể hiện tính khử mạnh:
M → M2+ + 2e
* Phản ứng với axit HCl, H2SO4 loãng thì phản ứng giải phóng khí H2.
2H+ + 2e → H2
* Phản ứng với dung dịch H2SO4 đặc, dung dịch HNO3
SO42- → SO2, S
NO3- → NH4+, N2, N2O, NO, NO2
Ví dụ 8:X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). X là kim loại
A. magie. B. beri. C. canxi. D. bari.
Hướng dẫn giải
Gọi là kí hiệu tương đương của hai kim loại X và Zn có hoá trị II
+ 2HCl → + H2 (1)
0,03 mol 0,03 mol
X + H2SO4 → XSO4 + H2 (2)
<0,05 <0,05
= 1,7/0,03 = 56,67 vì MZn = 65 nên X < 56,67
Mặt khác: X > 1,9/0,05 = 38
=> X là canxi (Ca)
Ví dụ 9:Cho 12,9 gam hỗn hợp Al, Mg phản ứng vừa hết với dung dịch H2SO4 đặc, nóng. Sau phản ứng thu được 0,125 mol S, 0,2 mol SO2 và dung dịch X. Cô cạn dung dịch X thu được m gam muối. Giá trị của m là :
- 68,1. B. 84,2. C. 64,2. D. 123,3.
Hướng dẫn giải
Ta có các quá trình khử :
8H+ + SO42- + 6e S + 4H2O (1)
mol: 1 0,125 0,75 0,125
4H+ + SO42- + 2e SO2 + 2H2O (2)
mol: 0,8 0,2 0,4 0,2
Căn cứ vào các quá trình khử (1) và (2) ta có:
số mol H+ = 1 + 0,8 = 1,8 mol
H2SO4 → 2H+ + SO42-
mol: 0,9 1,8 0,9
số mol SO42- phản ứng tạo S và SO2 = 0,125 + 0,2 = 0,325 mol
=> số mol SO42- tạo muối = 0,9 – 0,325 = 0,574 mol
Vậy khối lượng muối sunfat thu được = khối lượng kim loại + khối lượng SO42- tạo muối = 12,9 + 0,575.96 = 68,1 gam
=> Đáp án A
Dạng 4: Phản ứng với dung dịch muối
* Với dung dịch muối, kim loại kiềm thổ có thể đẩy kim loại yếu hơn ra khỏi muối
M → M2+ + 2e
* Muối phản ứng thể hiện tính oxi hóa:
An+ + ne → A
Ví dụ 10: Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là :
- 2,88. B. 2,16. C. 4,32. D. 5,04.
Hướng dẫn giải
Khi cho Mg vào dung dịch muối Fe3+, đầu tiên Mg khử Fe3+ thành Fe2+, sau đó Mg khử Fe2+ về Fe. Vậy phản ứng (1) xảy ra xong sau đó mới đến phản ứng (2).
Giả sử tất cả lượng Fe2+ chuyển hết thành Fe thì khối lượng sắt tạo thành là 6,72 gam. Trên thực tế khối lượng chất rắn thu được chỉ là 3,36 gam, suy ra Fe2+ chưa phản ứng hết, Mg đã phản ứng hết, 3,36 gam chất rắn là Fe tạo thành.
Phương trình phản ứng :
Mg + 2Fe3+ → Mg2+ + 2Fe2+ (1)
mol: 0,06 0,12 0,06 0,12
Mg + Fe2+ → Mg2+ + Fe (2)
mol: 0,06 0,06 0,06 0,06
Căn cứ vào (1) và (2) suy ra : số mol Mg = 0,06+0,06 = 0,12 mol
=> khối lượng Mg = 0,12.24 = 2,88 gam
=> Đáp án A.
Dạng 5: Các muối chứa ion Ca2+, Ba2+, Mg2+ phản ứng với dung dịch muối CO32-
* Phản ứng trong dung dịch tạo kết tủa:
Mg2+ + CO32– MgCO3
Ba2+ + CO32– BaCO3
Ca2+ + CO32– CaCO3
Ví dụ 11:Dung dịch A có chứa 5 ion : Mg2+, Ba2+, Ca2+, 0,1 mol Cl– và 0,2 mol NO3–. Thêm dần V lít dung dịch K2CO3 1M vào A đến khi được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml. B. 300 ml. C. 200 ml. D. 250 ml.
Hướng dẫn giải
Phương trình ion rút gọn :
Mg2+ + CO32– MgCO3
Ba2+ + CO32– BaCO3
Ca2+ + CO32– CaCO3
Khi phản ứng kết thúc, các kết tủa tách khỏi dung dịch, phần dung dịch chứa K+, Cl– và NO3–.
Theo định luật bảo toàn điện tích thì số mol K+ = số mol Cl– + số mol NO3–.
= 0,3 mol => số mol K2CO3 = 1/2.số mol K+ = 0,15 mol => V = 0,15 lít = 150 ml.
=> Đáp án A.
Dạng 6: Phản ứng của dung dịch Ca(OH)2, Ba(OH)2 với CO2
1. CO2 (hoặc SO2) phản ứng với dung dịch chứa một bazơ tan.
● Khi đề bài yêu cầu xác định và tính toán lượng sản phẩm tạo thành thì ta dựa vào tỉ lệ số mol OH-: số mol CO2
● Khi đề bài yêu cầu tính lượng CO2 phản ứng thì ta tính mol của Ca(OH)2 hoặc Ba(OH)2 và tính mol của kết tủa BaCO3 hoặc CaCO3. So sánh số mol của bazơ và của kết tủa nếu số mol của kết tủa nhỏ hơn thì sẽ có hai khả năng xảy ra : Hoặc bazơ dư hoặc bazơ hết. Trường hợp bazơ hết thì phản ứng phải tạo ra cả muối axit.
● Khi đề yêu cầu xác định lượng Ca(OH)2 hoặc Ba(OH)2 tham gia phản ứng thì ta tính mol CO2 và mol của kết tủa BaCO3 hoặc CaCO3 rồi áp dụng định luật bảo toàn nguyên tố đối với C để xem phản ứng có tạo ra muối Ca(HCO3)2 hoặc Ba(HCO3)2 hay không. Từ đó áp dụng định luật bảo toàn nguyên tố đối với Ca hoặc Ba để suy ra lượng Ca(OH)2 hoặc Ba(OH)2.
2. Phản ứng của CO2 (hoặc SO2) với dung dịch chứa hỗn hợp các bazơ tan.
- Bản chất phản ứng : CO2 + 2OH- → CO32- + H2O
CO2 + CO32- + H2O → 2HCO3-
- Nếu dung dịch kiềm có Ba(OH)2 hoặc Ca(OH)2 thì còn có thể có phản ứng tạo kết tủa nếu phản ứng của CO2 với OH- tạo ra CO32-
Ba2+ + CO32- → BaCO3↓
Ca2+ + CO32- → CaCO3↓
- Dựa vào giả thiết và các phương trình phản ứng ion rút gọn để tính toán suy ra kết quả cần tìm.
Ví dụ 12:Hấp thụ hoàn toàn 2,688 lít khí CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là :
A. 0,048. B. 0,032. C. 0,04. D. 0,06.
Hướng dẫn giải
Theo giả thiết ta có : số mol CO2 = 2,688/22,4 = 0,12 mol; kết tủa là BaCO3 do đó có số mol = 15,76/ 197 = 0,08 mol
Phương trình phản ứng : CO2 + Ba(OH)2 → BaCO3 + H2O (1)
mol: 0,08 0,08 0,08
=> Số mol CO2 tạo muối axit = 0,12 – 0,08 = 0,04
2CO2 + Ba(OH)2 → Ba(HCO3)2 (2)
mol: 0,04 0,02 0,02
Theo (1), (2) => số mol Ba(OH)2 = 0,08+0,02 =0,1 mol
=> [ Ba(OH)2] = 0,1/2,5 = 0,04 mol/lit
=> Đáp án C.
Dạng 7: Muối cacbonat của kim loại kiềm thổ phản ứng với dung dịch axit
* Phản ứng trong dung dịch : CO32-+ 2H+ → CO2 + H2O
Ví dụ 13: Hoà tan hoàn toàn 4 gam hỗn hợp MCO3 và M’CO3 vào dung dịch HCl thấy thoát ra V lít khí (đktc). Dung dịch thu được đem cô cạn thu được 5,1 gam muối khan. Giá trị của V là
A. 1,12 lít. B. 1,68 lít. C. 2,24 lít. D. 3,36 lít.
Hướng dẫn giải
Đặt công thức trung bình của hai muối cacbonat là
Phương trình phản ứng :
+ 2HCl + CO2 + H2O (1)
mol: x x x
Theo (1) ta thấy sau phản ứng khối lượng muối tăng là do muối clorua sinh ra có khối lượng lớn hơn khối lượng muối cacbonat ban đầu.
Ta có : (M + 71)x – (M + 60)x = 5,1 – 4
=> x = 0,1 mol
=> VCO2 = 0,1.22,4 = 2,24 lít.
=> Đáp án C.
Dạng 8: Phản ứng nhiệt phân muối cacbonat
* Muối cácbonat và hiđrô cacbonat của kim loại kiềm thổ khi nhiệt phân:
MCO3 → MO + CO2↑
* Đối với dạng bài tập này ta thường sử dụng phương pháp tăng giảm khối lượng.
Ví dụ 14: X là 1 loại đá vôi chứa 80% CaCO3, phần còn lại là tạp chất trơ. Nung 50 gam X một thời gian, thu được 39 gam chất rắn. % CaCO3 đã bị phân huỷ là
- 50,5%. B. 60%. C. 62,5%. D. 65%.
Hướng dẫn giải
Giả sử có 100 gam đá vôi thì khối lượng của CaCO3 là 80 gam. Do đó trong 50 gam X có 40 gam CaCO3.
Phương trình phản ứng hóa học :
CaCO3 → CaO + CO2
mol: x x
Theo phương trình và theo giả thiết ta có :
100x – 56x = 50 – 39 = 11 x = 0,25
Vậy % CaCO3 bị phân hủy là 0,25 : 40 = 0,625
=> Đáp án C.
3. Bài tập về nhôm và các hợp chất của nhôm
- Bản chất phản ứng của kim loại nhôm với các chất (phi kim; dung dịch : kiềm, axit, muối; phản ứng nhiệt nhôm...) là phản ứng oxi hóa - khử.
● Phương pháp giải các bài tập dạng này chủ yếu là sử dụng định luật bảo toàn electron. Ngoài ra có thể sử dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích, phương pháp đường chéo và tính toán theo phương trình phản ứng.
● Lưu ý : Trong phản ứng của kim loại Mg, Al, Zn với dung dịch HNO3 loãng thì ngoài những sản phẩm khử là khí N2, N2O, NO thì trong dung dịch còn có thể có một sản phẩm khử khác là muối NH4NO3. Để tính toán chính xác kết quả của bài toán ta phải kiểm tra xem phản ứng có tạo ra NH4NO3 hay không và số mol NH4NO3 đã tạo ra là bao nhiêu rồi sau đó áp dụng định luật bảo toàn electron để tìm ra kết quả .
Dạng 1: Nhôm tác dụng với phi kim
* Al thể hiện tính khử khi tác dụng với phi kim
Al → Al3+ + 3e
* Phi kim thể hiện tính oxi hóa:
Xn+ + ne → Xn-
Ví dụ 15:Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là :
A. 57 ml. B. 50 ml. C. 75 ml. D. 90 ml.
Hướng dẫn giải
Sơ đồ phản ứng : X + O2 → X2On → XCln
Áp dụng định luật bảo toàn khối lượng ta có : khối lượng X + khối lượng O2 = khối lượng Y
=> khối lượng O2 = 3,33 – 2,13 = 1,2 gam
=> số mol O2 = 1,2 /32 = 0,375 mol
Quá trình khử: O2 +4e → 2O2- (1)
mol: 0,375 0,075
Phản ứng Y với HCl: O2- + 2H+ → H2O (2)
mol: 0,075 0,15
Phương trình điện li HCl → H+ + Cl- (3)
mol: 0,015 0,015
Vậy thể tích HCl cần dùng = 0,15/2 = 0,075 lít = 75 ml
=> Đáp án C.
Dạng 2: Nhôm tác dụng với dung dịch kiềm và dung dịch muối nitrat trong môi trường kiềm
* Phản ứng của Al với dung dịch kiềm
2Al + 2H2O + 2OH- → 2AlO2- + 3H2 (1)
* Phản ứng với muối nitrat trong môi trường kiềm, có phản ứng (1) và có thêm (2)
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3 (2)
Ví dụ 16:Cho hỗn hợp gồm Na và Al có tỉ lệ số mol tương ứng là 1: 2 vào nước (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và chất rắn không tan. Khối lượng chất rắn còn lại sau phản ứng là
A. 5,04 gam. B. 10,8 gam. C. 2,7 gam. D. 5,4 gam.
Hướng dẫn giải
Gọi x là số mol Na trong hỗn hợp => số mol Al trong hỗn hợp là 2x
2Na + 2H2O → 2Na+ + 2OH- + H2
mol: x x x/2
2Al + 2H2O + 2OH- → 2AlO2- + 3H2
mol: x x 3x/2
Sau phản ứng Al dư là x mol
Ta có: x/2 + 3x/2 = 0,4 => x = 0,2
Khối lượng chất rắn còn lại sau phản ứng là: 27.02 = 5,4 gam.
=> Đáp án D
Ví dụ 17: Cho 48,6 gam Al vào 450 ml dung dịch gồm KNO3 1M, KOH 3M sau phản ứng hoàn toàn thể tích khí thoát ra ở đktc là :
A. 30,24 lít. B. 10,08 lít. C. 40,32 lít. D. 45,34 lít.
Hướng dẫn giải
Theo giả thiết ta có : số mol Al = 46,8/27 = 1,8 mol ; số mol KNO3 = 1.0,45 = 0,45 mol; số mol KOH = 3.0,45 = 1,35 mol
KNO3 → K+ + NO3-
mol: 0,45 0,45
KOH → K+ + OH-
mol: 1,35 1,35
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3 (1)
mol: 1,2 0,45 0,75 0,45
2Al + 2OH- + 2H2O → 2AlO2- + 3H2 (2)
mol: 0,6 0,6 0,9
Theo giả thiết và phản ứng (1) ta thấy : Sau phản ứng (1) Al còn dư là 0,6 mol và OH- dư là 0,6 mol nên tiếp tục xảy ra phản ứng (2).
Theo (1) và (2) ta suy ra khí thu được gồm NH3 và H2.
=> Thể tích của hỗn hợp khí = (0,45+0,9).22,4 = 30,24 lit
=> Đáp án A.
Dạng 3: Nhôm tác dụng với dung dịch axit
* Al thể hiện tính khử khi tác dụng với axit
Al → Al3+ + 3e
* Với HCl, H2SO4 loãng
2H+ + 2e → H2
* Với H2SO4 đặc nóng hoặc HNO3 : SO42- → S, SO2; NO3- → NH4+, NO, N2O, N2..
Ví dụ 18:Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 loãng thu được 1,12 lít hỗn hợp X gồm 3 khí NO, N2O, N2 có tỉ lệ số mol là: 1 : 2 : 2. Giá trị của m là :
- 5,4 gam. B. 3,51 gam. C. 2,7 gam. D. 8,1 gam.
Hướng dẫn giải
Theo giả thiết ta có số mol hỗn hợp khí = 1,12/22,4 = 0,05 mol
Mặt khác, tỉ lệ mol của 3 khí NO, N2O, N2 là 1 : 2 : 2 nên suy ra số mol tương ứng là 0,01; 0,02 và 0,02.
Các quá trình oxi hóa – khử :
Al → Al+3 + 3e
mol : x 3x
NO3- + 4H+ + 3e → NO + 2H2O
mol : 0,03 0,01
2NO3- + 10H++ 8e → N2O + 5H2O
mol : 0,16 0,02
2NO3- + 12H+ + 10e → N2 + 6H2O
mol : 0,2 0,02
Áp dụng định luật bảo toàn electron ta có : 3x = 0,03 + 0,16 + 0,20 => x = 0,13 mol
=> khối lượng Al = 0,13.27 = 3,51 gam
=> Đáp án B.
Dạng 4: Nhôm tác dụng với oxit kim loại (phản ứng nhiệt nhôm)
Ví dụ 19: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là :
A. 48,3. B. 45,6. C. 36,7. D. 57,0.
Hướng dẫn giải
Sơ đồ phản ứng: m gam h.h Al và Fe3O4 → h.h X rắn
↓ (+ dd NaOH dư)
(dd Y + rắn Z + 3,36 lít H2)
↓ (+ CO2)
39 gam kết tủa
Số mol H2 = 3,36/22,4 = 0,15 mol
8Al + 3Fe3O4 → 9Fe + 4Al2O3 (1)
mol: x (3/8)x x/2
Hỗn hợp sau phản ứng nhiệt nhôm tác dụng được với dung dịch NaOH nên Al dư, Fe3O4 phản ứng hết
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
mol: x/2 x
2Al (dư) + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (3)
mol: 0,1 0,1 0,15
Dung dịch Y có (0,1 + x) mol NaAlO2 do đó sục CO2 vào dung dịch Y thì NaAlO2 → Al(OH)3↓ (4)
Kết tủa là Al( OH)3 = 39/78 = 0,5 mol
Theo (4) => số mol NaAlO2 (trong dd Y) = số mol Al( OH)3 = 0,5 mol
=> 0,1 + x = 0,5 => x = 0,4 mol
=> sô mol Fe3O4 = (3/8)x = 0,15 mol
Vậy m = (0,4 + 0,1).27 + 0,15.232 = 48,3 gam.
=> Đáp án A.
Dạng 5 : Dung dịch muối nhôm phản ứng với dung dịch kiềm
* Nếu cho từ từ dung dịch kiềm mạnh vào dung dịch muối nhôm nhận thấy lúc đầu có kết tủa keo trắng, sau đó kết tủa tan dần dung dịch trở nên trong suốt do có phản ứng sau:
Al3+ + 3 OH- → Al(OH)3↓ (1)
Al(OH)3 + OH- → AlO2- + 2H2O (2)
- Nếu cho từ từ đến dư dung dịch muối nhôm vào dung dịch kiềm hoặc đổ dung dịch kiềm dư vào dung dịch muối nhôm thì không thấy có hiện tượng gì.
- Nếu nAl3+ > nAl(OH)3 thì phải xét 2 trường hợp:
Trường hợp 1: Lượng OH- không đủ để làm kết tủa hết lượng ion Al3+.
Al3+ + 3 OH- → Al(OH)3↓
Vậy nOH- = 3n↓
Trường hợp 2: Lượng OH- làm kết tủa hết lượng ion Al3+ sau đó 1 phần kết tủa bị hòa tan do OH dư => xảy ra 2 phản ứng, theo thứ tự phản ứng (1) => (2)
Al3+ + 3 OH- → Al(OH)3 ↓ ( 1)
Al(OH)3 + OH- → AlO2- + 2H2O (2)
Từ (1) và (2) => nOH- = 4nAl3+ - n↓ phản ứng với một phần Al(OH)3
- Chú ý các thuật ngữ : nhỏ từ từ, tính lượng kiềm lớn nhất, nhỏ nhất, lượng kết tủa lớn nhất, nhỏ nhất để xác định đúng trường hợp phản ứng.
Ví dụ 20:Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa như trên là
A. 0,45 lít. B. 0,9 lít. C. 0,6 lít. D. 0,42 lít.
Hướng dẫn giải
Phương trình ion thu gọn
Al3+ + 3OH- → Al(OH)3
0,2 0,6 0,2
H+ + OH- → H2O
0,2 0,2
Số mol kết tủa thu được là 0,1 mol, nên ta có phản ứng hoà tan một phần kết tủa
Al(OH)3 + OH- → AlO2 - + 2H2O
0,1 0,1
Số mol NaOH = số mol OH- = 0,9 mol
Thể tích NaOH lớn nhất để thu được lượng kết tủa như trên là:
VNaOH = 0,9/2 = 0,45 lít
=> Đáp án A
Ví dụ 21:Cho m gam kali vào 300ml dung dịch chứa Ba(OH)2 0,1M và NaOH 0,1M thu được dung dịch X. cho từ từ dung dịch X vào 200ml dung dịch Al2(SO4)3 0,1M thu được kết tủa Y. Để thu được lượng kết tủa Y lớn nhất thì khối lượng K cần tham gia phản ứng là
A. 0,78 gam. B. 1,17 gam. C. 1,56 gam. D. 4,68 gam.
Hướng dẫn giải
K + H2O → KOH + H2
0,03 0,03
Ba(OH)2 → Ba2+ + 2OH-
0,03 0,06
NaOH → Na+ + OH-
0,03 0,03
Al2 (SO4)3 → 2Al3+ + 3SO42-
0,02 0,04 0,06
Để thu được lượng kết tủa là lớn nhất thì lượng OH- trong dung dịch X phải làm kết tủa hết ion Al3+ theo phương trình.
Al3+ + 3OH- → Al(OH)3
0,04 0,12
=> số mol OH- trong KOH = 0,03 mol
Khối lượng K cần dùng là: 39. 0,03 = 1,17 gam.
=> Đáp án B










