Cấu trúc phân tử hợp chất hữu cơ
I. THUYẾT CẤU TẠO HÓA HỌC:
1 . Nội dung của thuyết cấu tạo hóa học:
a. Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hoá trị và theo một thứ tự nhất định. Thứ tự liên kết đó được gọi là cấu tạo hoá học. Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hoá học, sẽ tạo ra hợp chất khác
Ví dụ: C2H6O có 2 thứ tự liên kết
CH3–O–CH3 : đimetyl ete , chất khí , không tác dụng với Na.
CH3–CH2–OH: ancol etylic, chất lỏng, tác dụng với Na giải phóng khí hidro .
b.Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những có thể liên kết với nguyên tử của các nguyên tố khác mà còn liên kết với nhau thành mạch cacbon.
|
CH3–CH2–CH2–CH3 (mạch không có nhánh - mạch thẳng) |
CH3–CH-CH3 (mạch có nhánh)
|
CH2 – CH2
CH2
CH2 – CH2 ( mạch vòng ) |
|
|
H H – C – H H Chất khí cháy |
Cl Cl – C – Cl Cl Chất lỏng không cháy |
||
c. Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử ) và cấu tạo hóa học (thứ tự liên kết các nguyên tử)
2. Ý nghĩa :
Thuyết cấu tạo hoá học giúp giải tích được hiện tượng đồng đẳng, hiện tượng đồng phân .
II. Đồng đẳng, đồng phân:
1. Đồng đẳng:
a. Thí dụ:
- Các hiđrocacbon trong dãy : CH4, C2H6, C3H8, C4H10, C5H12, ..., CnH2n+2, chất sau hơn chất trước 1 nhóm CH2 nhưng đều có tính chất hoá học tương tự nhau.
- Các ancol trong dãy : CH3OH, C2H5OH, C3H7OH, C4H9OH,... CnH2n+1OH cũng có thành phần hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau
b. Định nghĩa:
Những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng.
· Giải thích : Mặc dù các chất trong cùng dãy đồng đẳng có công thức phân tử khác nhau những nhóm CH2 nhưng do chúng có cấu tạo hoá học tương tự nhau nên có tính chất hoá học tương tự nhau.
2. Đồng phân:
a. Thí dụ:
Metyl axetat (CH3COOCH3), etyl fomiat (HCOOC2H5) và axit propionic (CH3CH2COOH) là 3 chất khác nhau nhưng có cùng công thức phân tử là C3H6O2.
Etanol (C2H5OH) và đimetyl ete (CH3OCH3) là 2 chất khác nhau (có tính chất khác nhau) nhưng lại có cùng công thức phân tử là C2H6O.
b. Khái niệm:
Những hợp chất khác nhau nhưng có cùng công thức phân tử là những chất đồng phân.
· Giải thích : Những chất đồng phân tuy có cùng công thức phân tử nhưng có cấu tạo hoá học khác nhau, chẳng hạn etanol có cấu tạo H3C-CH2-O-H, còn đimetyl ete có cấu tạo H3C-O-CH3, vì vậy chúng là những chất khác nhau, có tính chất khác nhau.
III. Liên kết trong phân tử hợp chất hữu cơ:
1. Các loại liên kết trong phân tử hợp chất hữu cơ
Theo Li-uýt (Lewis), các nguyên tử có xu hướng dùng chung electron để đạt được 8 electron ở lớp ngoài cùng (Quy tắc bát tử), (đối với H chỉ cần đạt 2 electron).
- Liên kết tạo bởi 1 cặp electron dùng chung là liên kết đơn. Liên kết đơn thuộc loại liên kết σ. Liên kết đơn được biểu diễn bởi 2 dấu chấm hay 1 gạch nối giữa 2 nguyên tử.
- Liên kết tạo bởi 2 cặp electron dùng chung là liên kết đôi. Liên kết đôi gồm 1 liên kết σ và 1 liên kết π, biểu diễn bởi 4 dấu chấm hay 2 gạch nối.
- Liên kết tạo bởi 3 cặp electron dùng chung là liên kết ba. Liên kết ba gồm 1 liên kết σ và 2 liên kết π, biểu diễn bởi 6 dấu chấm hay 3 gạch nối.
- Liên kết đôi và liên kết ba gọi chung là liên kết bội.
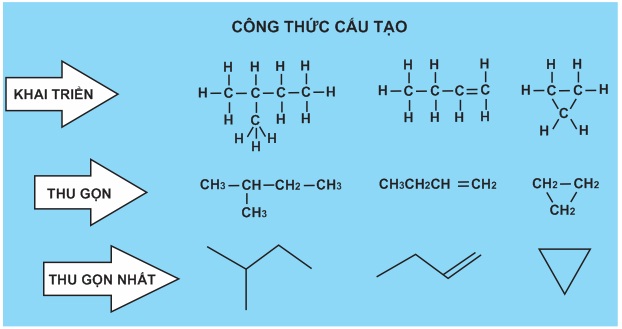
2. Các loại công thức cấu tạo
Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết của các nguyên tử trong phân tử. Có cách viết khai triển, thu gọn và thu gọn nhất.
Công thức cấu tạo khai triển : Viết tất cả các nguyên tử và các liên kết giữa chúng.
Công thức cấu tạo thu gọn : Viết gộp nguyên tử cacbon và các nguyên tử khác liên kết với nó thành từng nhóm.
Công thức cấu tạo thu gọn nhất : Chỉ viết các liên kết và nhóm chức, đầu mút của các liên kết chính là các nhóm CHx với x đảm bảo hoá trị 4 ở C.
IV. Đồng phân cấu tạo:
a. Khái niệm đồng phân cấu tạo
Những hợp chất có cùng công thức phân tử nhưng có cấu tạo hoá học khác nhau gọi là những đồng phân cấu tạo.
b. Phân loại đồng phân cấu tạo
- Đồng phân cấu tạo chia làm ba loại : Đồng phân mạch cacbon ; đồng phân nhóm chức và đồng phân vị trí nhóm chức.
- Những đồng phân khác nhau về bản chất nhóm chức gọi là đồng phân nhóm chức. Những đồng phân khác nhau về sự phân nhánh mạch cacbon gọi là đồng phân mạch cacbon. Những đồng phân khác nhau về vị trí của nhóm chức gọi là đồng phân vị trí nhóm chức.
V. Đồng phân lập thể
a. Khái niệm
Đồng phân lập thể là những đồng phân có cấu tạo hoá học như nhau (cùng công thức cấu tạo) nhưng khác nhau về sự phân bố không gian của các nguyên tử trong phân tử (tức khác nhau về cấu trúc không gian của phân tử).
b. Phân loại đồng phân lập thể:
- Đồng phân hình học: Điều kiện có đồng phân hình học
+ Có liên kết đôi C=C
+ Giả sử C(ab)=C(cd) phải có a ≠ b và c ≠ d
=> Đồng phân hình học có 2 dạng cis và trans

- Đồng phân quang học










